FERPLUS TRE TARDE – STUDIMI KLINIK
Testimi klinik mbi tolerancën dhe efektivitetin e plotësimit të hekurit organik me lirim të tabletës në tre hapa, për mungesën e hekurit profilaksia e anemisë gjatë shtatzënisë.
Abstrakt
Objektivi: Për arritjen e tolerancës dhe efektivitetit të hekurit organik, marrja orale e tabletave me lirim në tre hapa dhe gastro-mbrojtëse (FERPLUS® TRE-TARD 30mg) për profilaksinë e anemisë nga mungesa e hekurit te gratë shtatzëna.
Metodologjia: 40 gra shtatzëna janë rekrutuar për së paku 14 javë. Gjatë çerekut të parë të shtatzënisë vlera e hemoglobinës së tyre ishte ≥ 10g/dl. Pacientet janë trajtuar me 30 mg/ditë Hekur (1 tabletë/ditë FERPLUS® TRE-TARD 30mg). Hekuri është marrë oralisht deri në lindjen e fëmijës. Matja e gjakut është vlerësuar mbi gjendjen fillestare gjate javës së 24-të dhe 34-të/36-të të shtatzënisë (fundi i trajtimit); në të njëjtën kohe është vlerësuar edhe toleranca ndaj trajtimit.
Rezultatet: Asnjë nga 40 pacientet e përfshira në testim nuk ka raportuar vjellje, piroza, diarre dhe/apo kapsllëk në javën e 34-të/36-të të shtatzënisë (fundi i trajtimit). Vetëm një grua ka raportuar përzierje apo nauze. Për me tepër, rezultatet e fituara nga përfundimi i trajtimit nuk kanë treguar ndryshime substanciale të nivelit të hemoglobinës krahasuar me gjendjen fillestare.
Përfundimet: Plotësimi ditor me 30 mg të plotë Hekur (1 tablete/dite FERPLUS® TRE-TARD 30mg), në një grup të grave shtatzëna, është e lidhur me një sëmundshmëri të pamjaftueshme të anemisë dhe me një gamë shumë të mirë të tolerancës.
Parathënie
Hekuri është një mineral bazik për trupin sepse është i përfshirë në proceset në vijim: sinteza e hemoglobinës, mioglobinës dhe kolagjenit. Për më tepër, është thelbësore për procesin e frymëmarrjes qelizore dhe në metabolizmin e acideve nukleike. Anemia e shkaktuar nga mungesa e hekurit (anemi nga mungesa e hekurit) është njëri ndër problemet më të mëdha që e prek shëndetin publik. Testimet epidemiologjike kanë treguar për një numër të madh të grave që bëhen anemike (Hb < 10,5 g/dl) gjatë shtatzënisë në shtetet e zhvilluara apo në shtetet në zhvillim (1). Në fakt, në përgjithësi mbizotërimi i anemisë te gratë shtatzëna është 41,8% (2). Është e rëndësishme të mbani nivel të përshtatshëm të hemoglobinës gjatë shtatzënisë; nivel të Hb në mes të 9,5 dhe 10,5 g/dl gjatë çerekut të dytë kanë rol efektiv në shëndetin si të nënës ashtu edhe të fëmijës (3). Anemia mesatare (Hb në mes 7 dhe 9 g/dl) apo e rëndë (me pak se 7 g/dl) gjatë shtatzënisë është e ndërlidhur me rrezikun e lartë të vdekjes së nënës apo fetusit si dhe me rrezikun e lartë të infektimeve (4). Organet ndërkombëtare sugjerojnë që të përdoret në mënyrë rutinore suplementet e hekurit gjatë shtatzënisë në këtë aspekt (5); doza e sugjeruar e hekurit për parandalimin e anemisë nga mungesa e hekurit gjatë shtatzënisë është 60-400 mg/ditë. Trajtimi me kripëra hekuri, posaçërisht nëse është në doza të larta dhe që merret përmes gojës tregohet të jetë më efikas në shumicën e rasteve. Sidoqoftë, ky trajtim nuk është pa efekte anësore në nivelin gastrointestinal siç janë: diarreja, kapsllëku, të përzierat, urthi. Për më tepër, jo i tërë hekuri i gëlltitur absorbohet. Suplementi i hekurit 30 mg në ditë, shpërndahet në tableta gastro-mbrojtëse për të rritur tretjen që mund të jetë efikas në parandalimin e anemisë nga mungesa e hekurit dhe mund të parandalojë efektet anësore që ndërlidhen me tretjen e mineraleve.
Pacientet dhe metodologjia
Ky është një testim klinik që ka për qëllim të vlerësoj tolerancën dhe efikasitetin e suplementit oral të hekurit nga tri burime organike dhe në lirim në tre hapa, përmes tabletave gastro-mbrojtëse (FERPLUS® TRE-TARD 30mg) për parandalimin e anemisë nga mungesa e hekurit te gratë shtatzëna. Ky testim perspektiv, me shume qendra dhe me klasifikim të hapur është kryer në 40 paciente. Kriteret e përfshirjes në testim kanë qenë: (1) gratë që kanë më shumë se 18 vjeç dhe më pak se 40 vjeç; (2) gratë shtatzëna për së paku 14 javë; (3) Hb ≥ 10g/dl gjatë çerekut të parë; (4) pacientet që janë në gjendje të marrin terapinë orale. Kriteret e mos përfshirjes në testim: (1) pacientet që pinë duhan; (2) diabeti mellitus, hipertensioni kronik; (3) aborti; (4) hemorragji gjatë shtatzënisë; (5) karcinoma; sëmundjet gastrointestinale; sëmundjet hematologjike; (6) pacientet me kundër indikacione nga përdorimi i hekurit dhe/apo elemente tjera që përmban FERPLUS® TRE-TARD 30mg; (7) pacientet të përfshira në të njëjtën kohë në disa prova klinike. Përdorimi i njëkohshëm i suplementeve të tjera ushqimore me Hekur dhe/apo terapitë që janë në konflikt të dukshëm me praktiken klinike të ndërlidhur me gjendjen klinike dhe trajtimin e vrojtuar është ndaluar.
Pjesëmarrëset janë ftuar të fillojnë trajtim me 1 tabletë/ditë FERPLUS® TRE-TARD 30mg, që merret në mënyrë orale, që nga rekrutimi e deri në lindjen e foshnjës. Bëhet fjalë për tabletat gastro-mbrojtëse me tri shtresa, me një lirim në 4 orë në menyre që të garantojnë një transferim të ngadaltë dhe të qëndrueshëm të mineraleve në duoden dhe shton në maksimum tretjen e tij. Hekuri që përmbajnë tabletat vie nga tre burime organike: Bisglicinoni (10mg), Fumarate i mikroskapsuluar (10mg) dhe Pidolit (10mg), në formë të hekurit me ngjyra (i cili është më së shumti në dispozicion biologjikisht). Përveç kësaj, secila tablete përmban Vitamin B12, C, Beta-karoten dhe 400 mcg të Acidit Folik, shtesa e të cilit është shumë e domosdoshme gjatë shtatzënisë për të zvogëluar rrezikun e mungesave në tubin nervor (p.sh. spina bifida, anencefalia dhe encefalacela) si dhe të keq-formimeve të tjera, në veçanti të atyre kardiovaskulare dhe kongjenitale.
Qëllimi i testimit
Qëllimi kryesor i këtij testimi ka qenë për të vlerësuar tolerancën 1 tabletë/ditë të FERPLUS® TRE-TARD 30mg gjatë ditëve të trajtimit. Objektivi dytësor ka qenë që të hetohet paraprakisht efektiviteti i trajtimit në profilaksinë e anemisë nga mungesa e hekurit në gratë shtatzëna për të paktën 14 javë.
Mbledhja e të dhënave
Për pjesëmarrëset janë programuar tri kontrolle mjekësore për mbledhjen e të dhënave dhe për matjen e gjakut: kontrolli i parë (kryesor) për ekzaminim dhe fillim të trajtimit; i dyti në javën e 24-të të shtatzënisë; i treti (në fund të trajtimit) ne javën e 34-të/36-të të shtatzënisë. Të dhënat e mëposhtme janë mbledhur nga dosjet klinike të pjesëmarrëseve si dhe përmes intervistave personale nga një profesionist mjekësor: mosha, pesha, gjatësia, jave e shtatzënisë, humbja e gjakut, te vjellat, piroza, diarreja, kapsllëku. Për më tepër, janë raportuar edhe matjet e gjakut.
Rezultatet
Në momentin e rekrutimit, vlera mesatare e regjistruar e Hb ishte 12,6 g/dl, në një nivel që shkonte nga 10,3 deri në 14,5 g/dl; vlera e vrojtuar e Hb ishte e lidhur me një rrezik të mundshëm të zhvillimit të anemisë gjatë shtatzënisë nëse minerali nuk ishte përfshirë. Gratë e rekrutuara kanë filluar trajtimin në javën e 14-të/15-të të shtatzënisë (T°). Në javën e 34-të/36-të të shtatzënisë (fundi i trajtimit T1) vlera mesatare e regjistruar Hb ishte 12,4 g/dl (shih Figura 1).
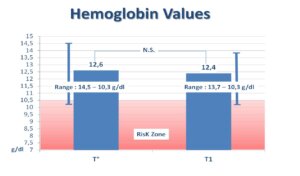
(Figura 1)
Hemoglobina e qelizës mesatare (MCH) dhe përqendrimi mesatar i hemoglobinës në qelizë (MCHC) janë vlerësuar mbi gjendjen fillestare gjithashtu, gjatë vizitës së dytë dhe në fund të trajtimit. Shtesa e 1 tablete/ditë e FERPLUS® TRE-TARD 30mg nuk ka sjellë ndonjë ndryshim substancial në asnjërin nga dy indekset korpuskulare. Të dy indekset kanë qëndruar brenda vlerave normale (MCH në mes 26 dhe 32 pikogramëve; MCHC në mes të 32% dhe 36%). Kjo tregon mungesë të anemisë (shih Figura 2 dhe Figura 3).
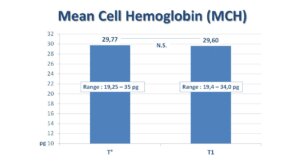 (Figura 2)
(Figura 2)
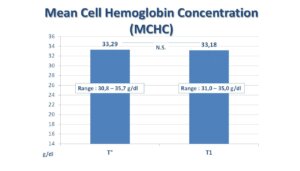
(Figura 3)
Gjatë trajtimit, asnjëra nga gratë nuk është larguar nga testimi për shkak të efekteve anësore. Për më tej, asnjë komplikim nuk është vrojtuar te gratë apo fetuset. Në tërësi, një nga katërdhjetë gratë ka raportuar se ka pasur të përziera në momentin e përfundimit të trajtimit, kurse 100% e grave nuk kanë pasur vjellje, piroza, diarre, kapsllëk. Krahasuar me gjendjen fillestare, në fund të trajtimit ka pasur ulje të të përzierave, diarresë dhe kapsllëkut (shih Tabela 1).
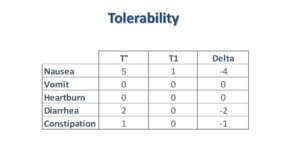 (Tabela 1)
(Tabela 1)
Shtjellim
Koncentrimi i Hb është një shënues efikas në monitorimin e nivelit të hekurit për të parë se a është e nevojshme të ketë suplemente (6). Gjatë këtij testimi, ndryshimi i këtij treguesi është vlerësuar në një grup grash shtatzëna të cilat ishin përzgjedhur dhe trajtuar me suplemente hekuri. Testimi tregoi që 30 mg/ditë e hekurit të marrë oralisht (1 tabletë/ditë e FERPLUS® TRE-TARD 30mg) janë të mjaftueshme për të parandaluar aneminë nga mungesa e hekurit në 100% të pacienteve të rekrutuara. Nivelet e vrojtuara në fillim të Hb (12,6 g/dl) dhe në fund të trajtimit (12,4 g/dl) në fakt nuk kishin raportuar ndryshime të rëndësishme. Në mënyrë të ngjashme, asnjë ndryshim i rëndësishëm nuk ishte regjistruar në fund të trajtimit krahasuar me nivelet fillestare të MCH dhe MCHC. Efektet më të zakonshme anësore gastrointestinale të lidhura me marrjen e hekurit janë te përzierat, vjellja, piroza, diarreja dhe kapsllëku. Për me tepër, 25% e grave që kanë marrë suplement të hekurit oralisht, kanë shfaqur efekte anësore të çfarëdo lloji. (7). Gjatë këtij testimi, vetëm një nga katërdhjetë gratë ka pasur të përziera në fund të trajtimit; nuk është regjistruar asnjë komplikim dhe/apo reaksion i padëshiruar që do të ndikonte në ndalimin e trajtimit. Përveç kësaj, shtesa e 1 tablete/ditë e FERPLUS® TRE-TARD 30mg ka garantuar furnizim me 400 mcg/ditë të Acidit Folik. Kjo e bën produktin si suplement referues për të gjithë shtatzëninë.
Përfundim
Suplementi i 30 mg/ditë e hekurit me lirimi të kontrolluar (1 tabletë/ditë e FERPLUS® TRE-TARD 30mg) nga java e 14-të e shtatzënisë është e lidhur me një sëmundshmëri të ulët të anemisë në gratë shtatzëna dhe për një tolerancë dhe pajtueshmëri shumë të mirë me produktin e përdorur.
Bibliografia
| 1. | McLean E, Cogswell M, Egli I, Wojdyla D, de Benoist B. Worldwide prevalence of anaemia, WHO Vitamin and Mineral Nutrition Information System, 1993-2005. Public Health Nutr. 2009 April; 12(4): p. 444–54. |
| 2. | McLean E, Egli I, de Benoist B, Wojdyla D, Cogswell M. Worldwide prevalence of anemia in preschool aged children, pregnant women and non-pregnant women of reproductive age. In Nutritional anemia.: Kraemer, Klaus; Zimmermann, Michael B; 2007. p. 1-12. |
| 3. | Beucher G, Grossetti E, Simonet T, Leporrier M, Dreyfus M. Iron deficiency anemia and pregnancy. Prevention and treatment. J Gynecol Obstet Biol Reprod. 2011 May; 40(3): p. 185–200. |
| 4. | Report of the 2001 International Nutritional Anemia Consultative Group Symposium. Why Iron Is Important and What to Do About It: A New Perspective. Hanoi:; 2001 March 03. |
| 5. | Broome CV. Recommendations to Prevent and Control Iron Deficiency in the United States. MMWR Recommendations and Reports. 1998 April 3; 47(3): p. 1-29. |
| 6. | WHO. Assessing the Iron Status of populations. Geneva, Switzerland: World Health Organization and Centers for Disease Control and Prevention. 2004;: p. 1-30. |
| 7. | Peña-Rosas J, Viteri F. Effects and safety of preventive oral iron or iron+folic acid supplementation for women during pregnancy. Cochrane Database Syst Rev.. 2009 Oct 7; 4. |

